Innanzitutto bilanciare una reazione chimica significa trovare dei coefficienti stechiometrici da porre davanti alla formula delle specie chimiche che costituiscono i reagenti ed i prodotti della reazione in modo tale che il numero totale degli atomi di tutti degli elementi presenti fra i reagenti sia uguale a quello fra i prodotti. Questo per la conservazione della massa. Consideriamo qualche esempio che illustra questo “nuovo” metodo di bilanciamento delle reazioni chimiche.
Consideriamo la reazione:
Poniamo davanti ad ogni specie chimica dei parametri arbitrari in questo modo:
Facciamo il bilancio degli atomi di N, fra i due membri della reazione:
per cui possiamo scrivere:
Facciamo il bilancio degli atomi di H, fra i due membri della reazione:
da cui si ricava:
per cui possiamo scrivere:
da cui si ricava:
per cui possiamo scrivere:
che è la reazione bilanciata.
Consideriamo un secondo esempio:
per cui:
da cui possiamo scrivere:
Facciamo il bilancio degli atomi di H:
per cui:
da cui possiamo scrivere:
Facciamo il bilancio degli atomi di I:
per cui:
per cui possiamo scrivere:
ponendo b=2 (per avere coefficienti stechiometrici interi) abbiamo infine:
che è la reazione bilanciata.
Penso che questi due esempi abbiano chiarito i passi fondamentali del metodo che volevo proporvi ossia:
1- assegnare dei parametri arbitrari ad ogni specie chimica che compare nella reazione
2- attraverso gli opportuni bilanci degli atomi andare ad eliminare progressivamente tutti i parametri tranne uno
3- assegnare a quest'ultimo parametro un valore opportuno in modo tale da ottenere coefficienti stechiometrici interi ed i più piccoli possibili.
Il passo più difficile è senz'altro il numero 2, infatti non esiste una regola per dire quale sia il bilancio atomico più opportuno da fare se non forse di cercare di fare quello ”più semplice possibile”.
Consideriamo un esempio in cui si presenta una piccola difficoltà nell'uso di questo metodo per vedere come superarla. Bilanciamo la reazione chimica seguente:
Ponendo i parametri abbiamo:
Facciamo il bilancio degli atomi di K:
da cui possiamo scrivere:
Facciamo il bilancio degli atomi di Mn:
da cui possiamo scrivere:
Facciamo il bilancio degli atomi di Cl:
per cui si ricava:
da cui possiamo scrivere:
Facciamo il bilancio degli atomi di O:
per cui si ricava:
da cui possiamo scrivere:
Facciamo ora l'ultimo bilancio possibile, quello per gli atomi di H:

per cui si ricava:
con questo risultato possiamo scrivere tutti gli altri coefficienti in funzione del solo parametro a; infatti con semplici calcoli si può verificare che si ha:
ponendo a=2 (per avere coefficienti interi) abbiamo infine:
che è la reazione bilanciata.
Come avete potuto vedere da questo esempio è stato necessario tenere, in una fase intermedia del bilanciamento, delle espressioni per i coefficienti stechiometrici che dipendevano da due parametri arbitrari (a e b), andando poi, nella fase finale, ad eliminare uno di questi parametri.
Penso che gli esempi visti siano sufficienti per capire il metodo di bilanciamento che volevo proporvi. Quel che posso consigliare, a chi vuole padroneggiare questo metodo appieno, è di fare quanti più esercizi possibile.
Spero che questo metodo sia utile a quegli studenti di cui parlavo all'inizio, fatemi sapere cosa ne pensate.
Si possono presentare casi in cui occorre tenere in considerazione le cariche delle varie specie chimiche per riuscire ad ottenere i coefficienti stechiometrici. Ho considerato questo caso qui.
Segnalo infine questo altro mio post in cui si parla di un bilanciatore on-line di reazioni chimiche che penso utilizzi un metodo analogo a quello che ho descritto qui.


















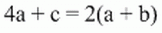



Sinceramente trovo più difficoltà a eseguirlo in questo modo che lei ha elencato che nel metodo insegnato dalla mia professoressa.
RispondiEliminaSegnala questo blog alla tua professoressa, penso che lo troverà interessante.
EliminaIn particolare segnala questo post.
EliminaUna domanda, per bilanciare gli atomi dei singoli elementi bisogna seguire un ordine ben preciso oppure è possibile per esempio, riferendomi all'ultima reazione, fare K, Mn, O, Cl?
RispondiEliminaSeguendo l'ordine che indichi K, Mn, O, Cl, H è persino più facile di come ho fatto io. L'ordine non ha importanza, ma la scelta più logica è quella di puntare ad ottenere espressioni che siano le più semplici possibili.
EliminaGrandissimo! Ho bilanciato una reazione lunghissima e assurda in questo modo :) In matematica me la cavo egregiamente quindi portare la chimica in matematica è per me fantastico :D
RispondiEliminaBrillante! Mi chiedo però se questo metodo valga anche per le ossido-riduzioni con composti ionici. Grazie in anticipo per la risposta.
RispondiEliminaEffettivamente nel caso di ossido-riduzioni ioniche si possono presentare dei problemi. Ho considerato la questione in questo post: http://chimicafacile.blogspot.it/2012/11/interessante-caso-di-bilanciamento-di.html
Eliminascusami ma nel secondo esempio che fai hai sbagliato.
RispondiEliminadove dici che O: 2b=b+e , penso che sia O: 2b=d+e
Se fai bene attenzione nel passaggio precedente a quello di cui stai parlando, attraverso il bilancio degli atomi di azoto (N) ho stabilito che d=b, per cui il procedimento è corretto.
Elimina